El átomo continuó durante siglos siendo un concepto filosófico hasta que a finales del siglo XVIII (Lavoisier) y principios del XIX (Dalton), por experimentación, llegaron a la conclusión que, aunque eran incapaces de verlos, los átomos realmente existían y midiendo algunas de sus propiedades dedujeron que los átomos de las distintas sustancias elementales o "elementos" eran todos iguales entre si pero diferentes de unos elementos a otros. Desde entonces quedó establecido que para las sustancias elementales, los átomos eran las partes más pequeñas de esas sustancias que conservaban sus propiedades.
En la vida diaria utilizamos algunas sustancias elementales (azufre, cobre, plata, oro, plomo, mercurio, etc.), sin embargo la inmensa mayoría de las sustancias que nos rodean son o bien sustancias compuestas (el agua, la sal, el azúcar, la cal, el amoniaco, etc) o bien mezclas de sustancias compuestas (rocas, tierras, petróleo, cementos, etc.). Los seres vivos y todos los alimentos y materiales que de ellos se extraen son caso aparte; son mezclas de infinidad de sustancias compuestas complejamente estructuradas.
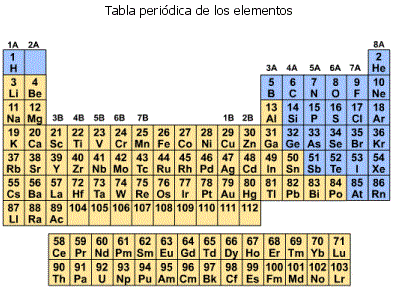
En el siglo XIX se conocían ya unos 60 elementos de los 90 que existen en la naturaleza. Al estudiarlos en su conjunto al ruso Mendeléyev y a otros científicos se les ocurrió la idea de agruparlos según sus propiedades químicas en diversas tablas. Además para facilitar la comunicación entre los distintos idiomas a los elementos se le asignaron nombres estándares consistentes en una o dos letras derivadas de sus nombres latinos. Por ejemplo: azufre S, cobre Cu, plata Ag, oro Au, etc.
La versión final conocida como Tabla Periódica de los Elementos demostró que esa organización revelaba realmente propiedades fundamentales de la constitución de los átomos y dio pié a la teoría atómica y a entender que, a pesar de su nombre, los átomos si eran divisibles. Además los huecos que aparecían en la Tabla Periódica original permitieron predecir la existencia de elementos que deberían existir pero que todavía no se conocían en aquella fecha. Este fue el caso del galio, germanio, tecnecio, etc. a los cuales se les pudo predecir incluso sus propiedades.
Si una ameba, animal unicelular de apenas un milímetro que es difícilmente visible a simple vista la ampliáramos hasta el tamaño del planeta Tierra, el virus de la gripe porcina (uno de los más pequeños) tendría el tamaño de la Giralda, una molécula de glucosa sería como una ballena y un átomo de hidrógeno, el átomo más simple que existe, tendría el tamaño de una naranja.
Juan Rojas

No hay comentarios:
Publicar un comentario